Tabla de Contenido
Las autoridades en Estados Unidos aprobaron el uso de la terapia de plasma convaleciente para pacientes con covid-19, pero algunos científicos dicen que se necesitan más estudios para probar su efectividad.
l presidente de Estados Unidos, Donald Trump, describió el tratamiento de plasma convaleciente como “una poderosa terapia” pese a que científicos de su país y otros creen que se necesitan más estudios para probar su efectividad.
El uso de ese tratamiento en EE.UU. acaba de ser autorizado por la Administración de Alimentos y Fármacos (FDA) para los pacientes con covid-19.
Ver también Trump autoriza uso de plasma sanguíneo contra el coronavirus
La terapia, que utiliza plasma, una parte de la sangre que contiene anticuerpos de personas que se han recuperado de covid-19, ya estaba siendo probada con unas 70,000 personas en Estados Unidos.
La FDA señala que los ensayos clínicos iniciales indican que la técnica es segura, pero varios científicos argumentan que no ha sido suficientemente probada.
El anuncio de la FDA surge un día después de que Trump acusó al organismo de impedir la aplicación de vacunas y terapias “por razones políticas”.
Y también se da en la víspera de la Convención Nacional Republicana, donde Trump será confirmado como el candidato de su partido para un segundo periodo en la Casa Blanca.
¿Qué es el plasma convaleciente?
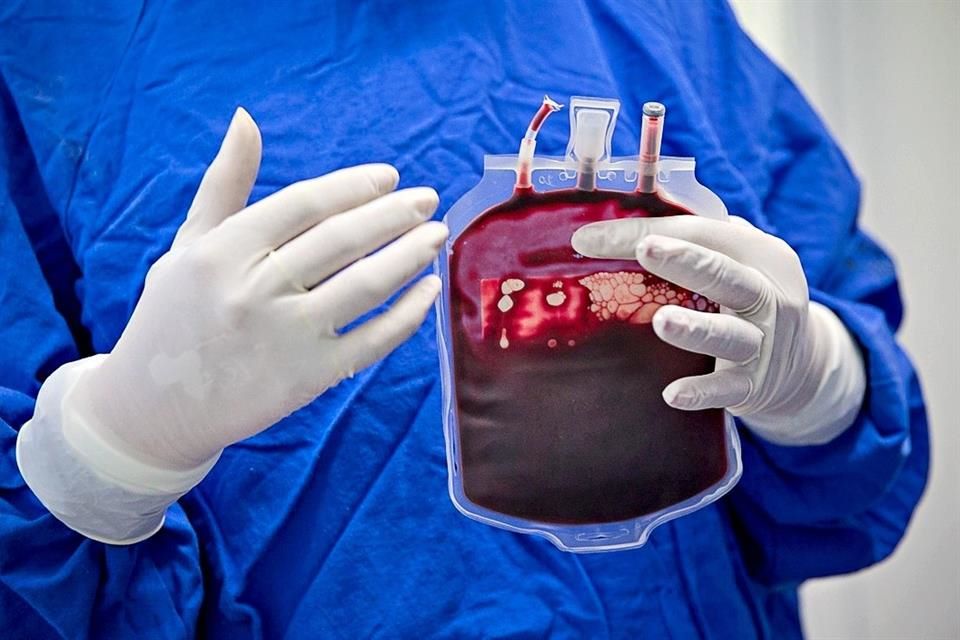
El plasma es una parte de la sangre que se obtiene al retirar los glóbulos rojos, glóbulos blancos y otros componentes.
Este líquido está compuesto por agua, sales, proteínas y anticuerpos, y por ello se utiliza para tratar a personas con deficiencias del sistema inmune y otros trastornos.
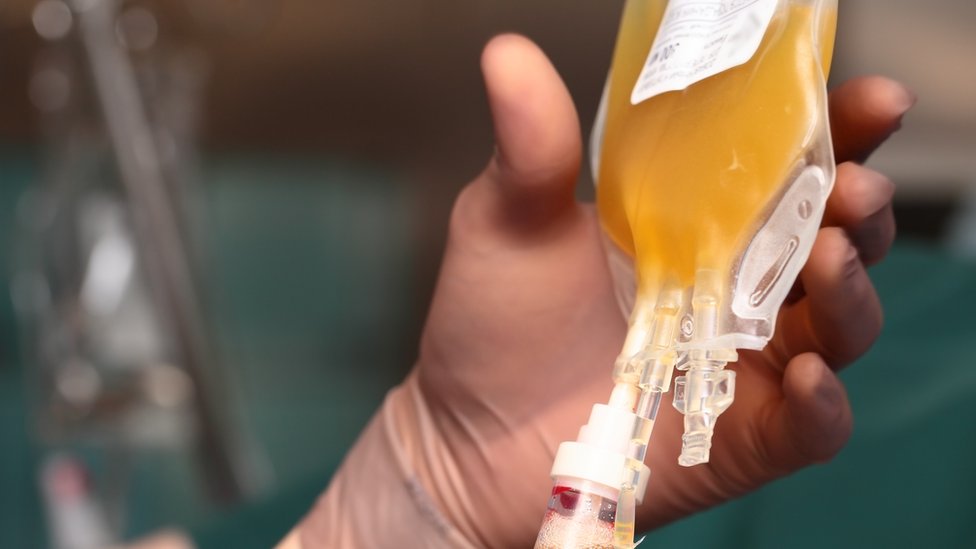
Ahora se piensa que las personas que se han recuperado de covid-19 tienen suficientes anticuerpos almacenados en el plasma para tratar a los pacientes que siguen luchando contra la enfermedad.
A fines de marzo, la FDA autorizó los ensayos clínicos del plasma convaleciente para investigar su impacto en los pacientes con covid-19.
Y permitió el uso de transfusiones de plasma en pacientes con coronavirus bajo ciertas condiciones.
Este fin de semana, el organismo otorgó una “autorización para uso de emergencia” del tratamiento, pero no fue totalmente aprobado.
¿Funciona el tratamiento?
Aunque los resultados iniciales parecían prometedores, no se cuenta con ensayos aleatorios que demuestren su verdadera efectividad.
La FDA, sin embargo, concluyó que la terapia “es segura” después de revisar los resultados de 20,000 pacientes que han recibido el tratamiento.
La agencia indicó que los resultados preliminares sugieren que el plasma puede reducir la letalidad y mejorar la salud de los pacientes si se administra durante los primeros tres días en que es ingresado en el hospital.
El organismo señaló que las personas menores de 80 años que no estaban conectadas a un respirador y habían recibido plasma con altos niveles de anticuerpos habían sido las que más se habían beneficiado con el tratamiento.
Estos pacientes habían mostrado, un mes después del tratamiento, una tasa de supervivencia un 35% mayor que quienes habían recibido plasma con un nivel menor de anticuerpos.
“Parece que el producto es seguro y estamos confiados en que seguiremos observando signos de seguridad que no son preocupantes”, indicó Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA.
Sin embargo, la semana pasada, cuando se supo que la FDA estaba considerando autorizar el uso de la terapia, un grupo de altos funcionarios de salud estadounidenses expresaron que los datos que se tienen hasta ahora sobre el plasma convaleciente son demasiado débiles y que es necesario seguir estudiándolo para probar su efectividad.
Entre ellos estaban el director de los Institutos Nacionales de Salud, Francis Collins; el director del Instituto Nacional de Alergias y Enfermedades Infecciosas, Anthony Fauci; y el subdirector H. Clifford Lane.
“Nosotros tres estamos totalmente de acuerdo en la importancia de datos robustos a través de ensayos de control aleatorios, y una pandemia no cambia eso”, le dijo el doctor Lane al diario The New York Times la semana pasada.
Análisis de Michelle Roberts
Editora de salud, BBC
Muchos países están usando plasma como terapia para el coronavirus, pero no está claro cuán efectivo es el tratamiento.
La decisión de la FDA de Estados Unidos de autorizar su uso de emergencia es un equilibrio de riesgos.
Dice que basada en la evidencia hasta ahora, el plasma convaleciente puede reducir la severidad o acortar la duración de la enfermedad de covid-19.
Ciertamente, los pacientes enfermos con coronavirus cuyos sistemas inmunes están luchando contra el virus de la pandemia podrían obtener protección con una transfusión de plasma rica en anticuerpos de alguien que se ha recuperado con éxito de covid-19.
El plasma convaleciente ha sido usado exitosamente para tratar otras enfermedades, incluido el ébola.
En general es bien tolerado, pero pueden ocurrir efectos no deseados, como reacciones alérgicas dañinas.
Un análisis reciente en Reino Unido señaló que sigue siendo “muy incierto” si el plasma es beneficioso para las personas hospitalizada con covid-19.
Continúan los ensayos para entender precisamente qué pacientes pueden beneficiarse y cómo.
Los expertos desean ver evidencia que cumpla los criterios de referencia para informar las decisiones que se tomen sobre el tratamiento. Y reunir esos datos tomará tiempo.
En una declaración, la Sociedad de Enfermedades Infecciosas de Estados Unidos indicó que aunque hay “algunas señales positivas de que el plasma convaleciente puede ser útil para tratar a individuos con covid-19… no hay datos de ensayos aleatorios controlados necesarios para entender mejor su utilidad como tratamiento para covid-19”.
Jonathan Reiner, profesor de medicina de la Universidad George Washington (EE.UU.), considera que la decisión es “una maniobra política”.
“El plasma convaleciente podría ser eficaz, pero necesitamos tener los datos definitivos”, escribió en Twitter.
La Organización Mundial de la Salud (OMS) señaló el mes pasado que “el plasma convaleciente para covid-19 puede hacerse disponible sobre una base experimental y a través de la producción local, siempre y cuando se cumplan los criterios éticos y de seguridad durante su preparación y uso”.